II) Principe de l'oxydation
Il existe plusieurs techniques pour obtenir un oxyde :
- l'oxydation thermique en présence d'oxygène, dite oxydation sèche,
- l'oxydation thermique par voie humide en présence d'oxygène et de vapeur d'eau,
- l'oxydation thermique vapeur en présence de vapeur d'eau uniquement,
- l'oxydation anodique, obtenue par voie électrochimique,
- l'oxydation plasma, réalisée à l'aide d'un plasma d'oxygène.
Notons que nous différentierons dans la suite, l'opération technologique d'oxydation de celle du dépôt d'oxyde qui n'entraîne pas les mêmes contraintes, thermiques notamment.
L'opération d'oxydation consiste donc à oxyder le Silicium depuis la surface du substrat. Les réactions principales sont les suivantes :
Si solide + O2 ---> SiO2 solide
Si solide + 2 H2O ---> SiO2 solide+ 2H2
Pour obtenir un oxyde de qualité électronique satisfaisante, on préfère l'oxydation thermique soit avec de l'oxygène, soit en présence de vapeur d'eau. En général, la croissance de l'oxyde avec de l'oxygène pur donne une croissance plus lente de l'oxyde qui lui confère de bonnes propriétés électroniques (peu de défauts électriquement actifs). La croissance avec de l'eau donne une croissance plus rapide mais plus de défauts électriques. Cette méthode sera donc préférée pour réaliser des oxydes épais (quelques milliers d'Angström) de masquage ou d'isolation.
Par ailleurs, le Silicium s'oxyde à température ambiante en présence de l'atmosphère (qui contient de l'oxygène) ; mais dès que la couche d'oxyde atteint 2 ou 3 couches atomiques, le phénomène d'oxydation se bloque. On dit que la couche est passivante. Pour obtenir une oxydation sur une "grande épaisseur", il faudra activer le phénomène par une élévation de température.
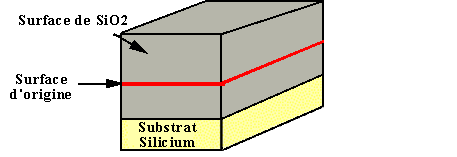
La couche de Silicium initiale réagit avec l'élément oxydant pour former le SiO2 ; on va ainsi consommer du Silicium. L'interface Si/SiO2 va donc se retrouver "au-dessous" de la surface initiale. Un calcul simple montre que la fraction d'épaisseur située "au-dessous" de la surface initiale représente 46% de l'épaisseur totale de l'oxyde ; la fraction "au-dessus" représente donc 54% (figure 37).

Figure 37 : Oxydation du Silicium. Une partie du substrat a été consommée lors de l'oxydation (d'après S.M. Sze [2]).
Cette augmentation de volume aura des conséquences importantes sur la planéité de la surface de la plaquette lorsque l'on réalisera des oxydations localisées. En effet, l'augmentation de volume sera locale et créera donc un relief comme représenté figure 38.
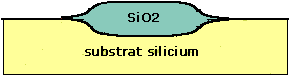
Figure 38 : Effet d'une oxydation localisée du Silicium. L'augmentation de volume crée un relief à la surface de la plaquette.
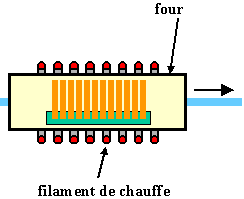
Les opérations d'oxydations s'effectuent en général dans des fours similaires à ceux de diffusion dans lesquels on fait circuler de l'oxygène, sec ou humide, ou de la vapeur d'eau (figure 39).
Toutefois, dans les technologies submicroniques, les plaquettes peuvent être traitées dans des réacteurs à chauffage très rapide à lampes (type halogène) en présence d'un élément oxydant. Cette technique s'appelle oxydation thermique rapide et sera revue plus loin.
On peut aussi créer la vapeur d'eau dans le four en effectuant une synthèse à partir d'un flux d'hydrogène et d'un flux d'oxygène. Cette réaction étant très exothermique, elle est donc dangereuse. Le dispositif contient alors un grand nombre de sécurités (détection de flamme, contrôle des débits, etc...) afin d'éviter toute explosion. C'est ce type de réacteur qui est principalement utilisé chez les industriels. Il faut noter que la pureté chimique des gaz employés doit être très bonne (pureté 5.0 minimum, c'est-à-dire moins de 10ppm d'impuretés totales).
 |
|
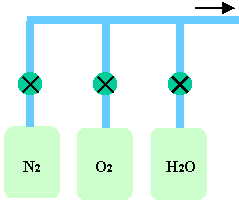 |
Figure 39 : Oxydation thermique avec de l'oxygène ou de la vapeur d'eau. On peut aussi fabriquer la vapeur d'eau à partir d'une torche à hydrogène brûlant en présence d'oxygène (oxydation vapeur ; O2 + 2 H2 ---> 2 H2O)